Forschung AK Hüttel
α-Ketosäureabhängige Enzyme als Katalysatoren für selektive Oxidationen
Eine besondere Herausforderung in der chemischen Synthese ist die gezielte Einführung funktioneller Gruppen an den vergleichsweise unreaktiven Kohlenwasserstoffketten von Molekülen (selective C–H-Aktivierung). Sieht man von einzelnen vielversprechenden Ergebnissen der letzten Jahre ab, ist dieser Reaktionstyp mit klassisch-chemischen Methoden nur sehr eingeschränkt durchführbar. Dagegen werden C–H-Aktivierungen in der Biosynthese von Naturstoffen häufig beobachtet. Die Erschießung der zugehörigen Enzyme für Wirkstoffsynthesen ist allerdings durch die hohe Empfindlichkeit und die schwierige Handhabung dieser Oxidoreduktasen erschwert.
Eine synthetisch bisher kaum beachtete Gruppe C–H-aktivierender Enzyme sind die Nicht-Häm-Fe(II)-Oxygenasen [Hüttel 2013]. In unserer Gruppe beschäftigen wir uns mit α Ketoglutarat(αKG)-abhängigen Dioxygenasen sowie den mechanistisch verwandten Hydroxyphenylpyruvat-Dioxygenasen (Hpd) und Hydroxymandelat-Synthasen (Hms). Ein Ziel ist es, durch Kombination verschiedener Substrate mit Enzymen unterschiedlicher Selektivität ein breites Spektrum neuer chiraler Synthesebausteine auch im präparativen Maßstab zugänglich zu machen. Daneben soll in Kooperation mit anderen Arbeitsgruppen über strukturbiologische und mechanistische Ansätze versucht werden, die Ursachen für die unterschiedlichen Regio- und Stereoselektivitäten der einzelnen Enzyme zu verstehen. Damit sollte es auch möglich werden, die katalytischen Eigenschaften der Enzyme durch Mutagenese gezielt zu verändern, beziehungsweise für bestimmte Substrate zu optimieren.
αKG/Fe(II)-abhängige Oxygenasen bilden eine große Gruppe von Enzymen, die Substrate mit molekularem Sauerstoff oxidieren. Dabei werden in der Regel Hydroxygruppen (-OH) eingeführt, aber es kann auch zur Bildung von Doppelbindungen, Umlagerungen oder sogar Halogenierungen kommen. Das Kosubstrat αKG dient als 2-Elektronen Donor und wird bei der Reaktion mit einem der Sauerstoff-Atome oxidativ decaboxyliert, wobei Succinat und Kohlendioxid entstehen.
Abbildung 1: Katalytische Oxidation mit einer αKG/Fe(II)-abhängigen Oxygenase
Im aktiven Zentrum des Enzyms befindet sich ein Eisen(II)-Ion, dass das an zwei Histidin- und einen Aspertat- bzw. Glutamat-Rest koordiniert ist. Mit dem zweiten Sauerstoffatom bildet es im Verlauf der einen hochreaktiven Eisen(IV)oxo-komplex, der das Substrat über einen radikalischen Mechanismus angreift. Bemerkenswert ist dabei, dass trotz dieses hochreaktiven Eisen(IV)-Komplexes die Reaktion am Substrat kontrolliert abläuft und in der Regel nur ein Produkt regio- und stereoselektiv gebildet wird.
Wegen ihrer einfachen Handhabung, ihrer hohen Selektivität, und des preisgünstigen Kosubstrats (αKG) stellen diese Enzyme in der Biokatalyse eine interessante Ergänzung zu den Cytochrom-P450 Oxygenasen dar.
1. Prolinhydroxylasen
Abbildung 2: Prolinhydroxylasen mit unterschiedlicher Regio- und Stereoselekivität. cis-P3H: cis-Prolin-3-hydroxylase; cis-P4H: cis-Prolin-4-hydroxylase; trans-P3H: trans-Prolin-3-hydroxylase; trans-P4H: trans-Prolin-4-hydroxylase.
Prolinhydroxylasen oxidieren freies L-Prolin mit hoher Regio- und Stereoselektivität zu Hydroxyprolinen (Hyp). Für alle der vier möglichen diastereomeren Produkte sind enzymatische Aktivitäten bekannt, allerdings kann trans-3-Hyp noch nicht mit vollständiger Regioselektivität dargestellt werden. Daneben akzeptieren Prolinhydroxylasen auch noch eine Reihe von anderen Substraten, so dass durch Variation von Enzymen und Substraten eine bemerkenswerte Vielfalt von chiralen chemischen Bausteinen zugänglich ist.
Forschung
In einem DFG-geförderten Kooperationsprojekt möchten wir die Ursachen für die unterschiedlichen Substratspezifitäten und katalytischen Selektivitäten auf molekularer Ebene aufklären. Die Untersuchungen werden interdisziplinär zusammen mit unseren Kooperationspartnern durchgeführt und umfassen: (i) Molekulare Spektroskopie, besonders EPR, (Dr. E. Schleicher), (ii) Kristallstrukturanalyse (Prof. O. Einsle), (iii) Modellierung (Jun. Prof. S. Günther) sowie (iv) Proteinproduktion, Enzymkatalyse, und Mutagenese (unsere Gruppe). Das bedeutet, in unserer Gruppe werden die Enzyme produziert und Varianten durch gerichtete Mutagenese als „Focused Libraries“ erzeugt. Von jedem Enzym wird das Substratspektrum mit einem Satz Prolin-ähnlicher Substrate getestet, die z. T. in unserer Gruppe synthetisiert werden. Die Katalyseprodukte sind auch im semi-präparativen (in vitro) und im präparativen Maßstab (in vivo mit rekombinanten E. coli-Zellen) zugänglich [Klein & Hüttel 2011]. Neue Verbindungen können so zum Beispiel über NMR vollständig charakterisiert werden. Außerdem können sie zur Synthese weiterer Substrate oder anderer chemisch schwer zugänglicher Verbindungen genutzt werden.
Finazierung
Seit 2014: Deutsche Forschungsgemeinschaft (DFG) Sachbeihilfe, Kooperationsprojekt mit Dr. Erik Schleicher.
2010–2012: Teile dieses Projekts wurden unterstützt durch die Deutsche Bundesstiftung Umwelt (DBU) Förderschwerpunkt Biotechnologie, Verbundprojekt AZ 13234-32 "Nachhaltige Biokatalytische Oxidationsprozesse".
2. Stereoselektive β-Hydroxylierung mit γ-Butyrobetain-Hydroxylase und Varianten
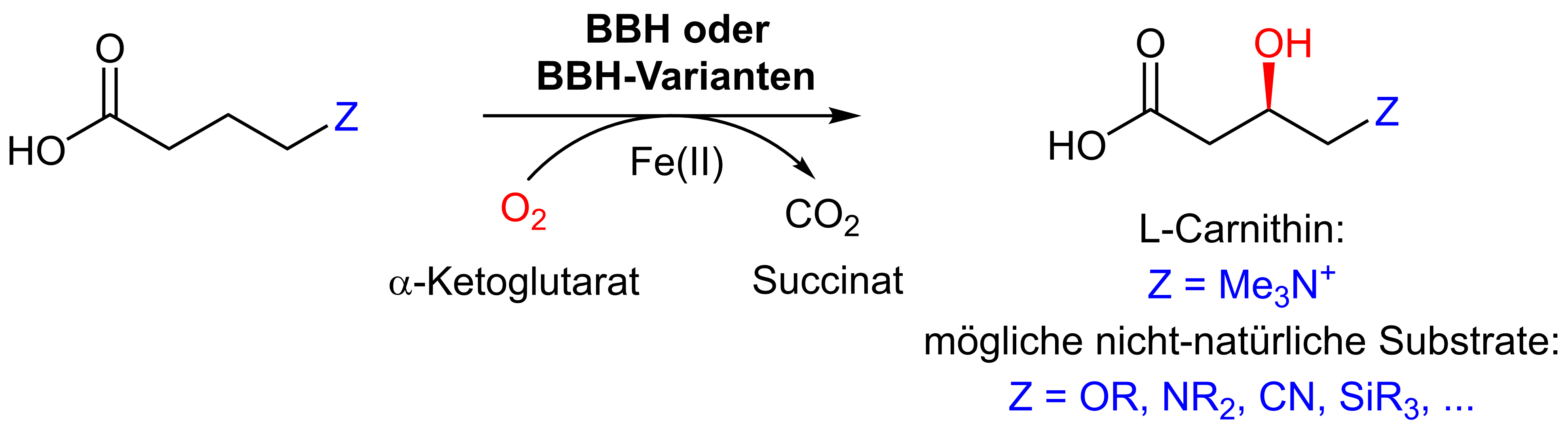
In diesem Projekt soll γ-Butyrobetain Hydroxylase (BBH) zur stereoselektiven β Hydroxylierung von Carbonsäuren etabliert werden. Da das native Produkt, L-Carnitin, wegen der Trimethylammonio-Gruppe als Synthesebaustein kaum geeignet ist, wird in diesem Projekt vor allem auf die Umsetzung nicht-natürlicher Substrate fokussiert, bei denen diese Gruppe gegen synthetisch einsetzbare funktionelle Gruppen ersetzt ist. Neben dem Screening von Wildtyp-Enzymen werden optimierte Varianten erzeugt, basierend auf (i) publizierten und eigenen Kristallstrukturen (Prof. O. Einsle), (ii) Molekularer Spektroskopie, insbesondere Elektronenspinresonanz ESR (Dr. E. Scheicher) und (iii) Modellierung (Jun. Prof. S. Günther).
Finanzierung
Deutsche Forschungsgemeinschaft (DFG) Graduiertenkolleg RTG 1976 „Funktionelle Diversität von Cofaktoren in Enzymen“.
3. Hydroxphenylpyruvatdioxygenase (HPPD) und verwandte Enzyme
Abbildung 3: Die unterschiedlichen Regioselektivitäten der Hydroxyphenylpyruvat-Dioxygenasen (Hpd) und Varianten sowie der der Hydroxymandelat-Synthasen (Hms) führen zu grundverschiedenen Produkten.
Die Hydroxyphenylpyruvat-Dioxygenase (Hpd) katalysiert Eukarionten einen zentralen Schritt des Tyrosin-Katabolismus, nämlich die Umsetzung von Hydroxyphenylpyruvat (HPP) zu Homogentisat (HGA), das Enzym wird aber auch in zahlreichen Bakterien gefunden. Der Reaktionsmechanismus ist komplex und umfasst eine oxidative Decarboxylierung, eine Umlagerung der Seitenkette des Aromaten sowie eine Hydroxylierung des aromatischen Kerns. Da eine oxidative CO2-Abspaltung am Substrat erfolgt, benötigt die Hpd kein Kosubstrat wie αKG. Auch die Proteinstruktur ist anders als bei den αKG-abhängigen Enzymen. Der Katalysemechanismus ist aber nahezu identisch.
Die Hydroxymadelat-Synthase (Hms) wird von einigen Bakterien zur Biosynthese von Antibiotika (Vancomycin, Sporolid A) benötigt. Sie ist mit der Hpd strukturell sehr eng verwandt und setzt auch dasselbe Substrat um. Allerdings wird HPP hier an der CH2-Einheit und nicht am Aromaten oxidiert, so dass Hydroxymandelsäure entsteht. Versuche durch Mutagenese Hpd in Hms umzuwandeln waren insofern erfolgreich, als Mutanten erzeugt wurden, die neben Homogentisinsäure auch Hydroxymandelsäure produzierten.
Forschung
In dem laufenden Projekt haben wir zwei ungewöhnliche Dioxygenasen untersucht:
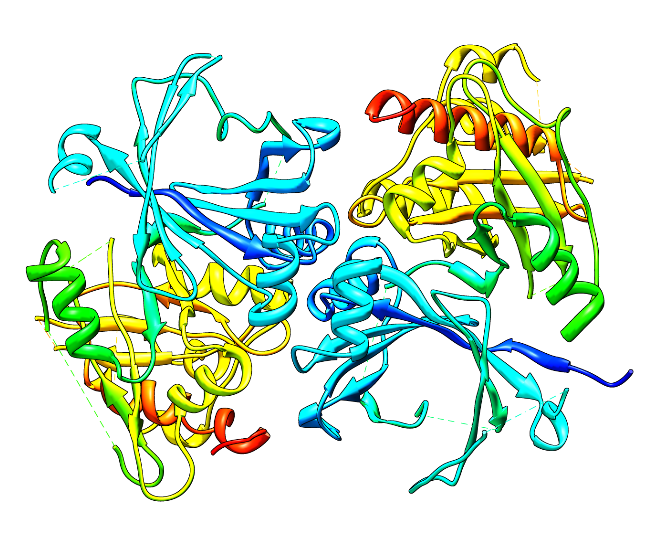
Die einzige bisher in Archaeen entdeckte Hpd stammt aus dem extremophilen Organismus Picrophilus torridus, der in warmen und stark sauren vulkanischen Quellen lebt. Das Enzym (Pt-Hpd) wurde in E. coli überproduziert, und insbesondere bei höheren Temperaturen und niedrigen pH-Werten auf seine katalytische Aktivität untersucht. Zusätzlich konnte in Zusammenarbeit mit der Gruppe von Prof. O. Einsle die Struktur mittels Kristallstrukturanalyse aufgeklärt werden. Die Ergebnisse belegen eindeutig eine Anpassung des Enzyms an die ungewöhnlichen Umweltbedingungen. Allerdings ist die Pt-Hpd bei weitem nicht so stabil, wie andere für P. torridus beschriebene Enzyme. Diese nur partielle Adaption der Pt-Hpd kann als Indiz für einen aus evolutiver Sicht relativ späten »Import« des Enzyms über einen lateralen Gentransfer interpretiert werden [Frick et al. 2014].
Structure of Pt-Hpd |
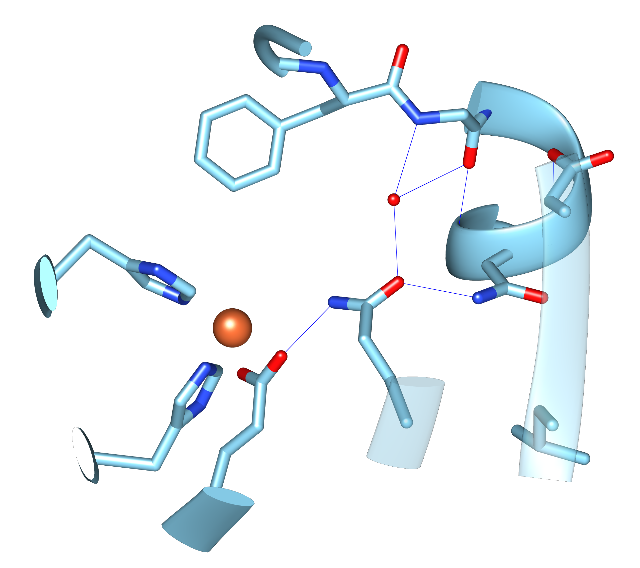
Structure of Ha-Hms – active site |
Die Dioxygenase Ha-Hms aus Herpetosiphon aurantiacus ist eindeutig eine Hydroxymandelatsynthase (Hms), obwohl sie in ihrer Aminosäuresequenz eher den Hpds als den bisher bekannten Hms ähnelt. In Zusammenarbei mit AK Prof. O. Einsle wurde die Struktur in einer Auflösung von 1.63 Å gelöst. Derzeit wird untersucht, warum das Enzym Hydroxymandelat und nicht Homogentisat produziert, und ob eine Hpd-Aktivität durch gerichtete Mutagenese induziert werden kann.